Spektroskopi kavramı geçmişte görünür bölge ışığının çeşitli dalga boylarına ayrılıp spektrumlarının elde edilmesi için kullanılırken günümüzde madde ile elektromagnetik ışığın etkileşimini inceleyen bilim dalı olarak tanımlanmaktadır. Spektrum kavramı bugün elektromanyetik ışıma ile madde arasındaki etkileşimlerle ilgilenmekten öteye giderek madde ve diğer enerji türleri arasındaki etkileşimleri de içerecek şekilde genişletilmiştir.
Spektroskopi, elektromanyetik ışımanın madde ile etkileşiminden ortaya çıkan spektrumların üretimi, ölçülmesi ve yorumlanması ile ilgilidir. Çok çeşitli analitik problemleri çözmek için kullanılabilen birçok farklı spektroskopik yöntem vardır. Bu yöntemler, analiz edilecek türe (moleküler veya atomik spektroskopi gibi), izlenecek ışıma-madde etkileşiminin türüne (absopsiyon, emisyon veya kırınım gibi) ve kullanılan elektromanyetik spektrumun alanına göre farklılık gösterir.
Spektroskopi ve spektrografi; dalga boyunun bir fonksiyonu olarak ışıma şiddetinin ölçümü için kullanılan terimlerdir ve genellikle deneysel spektroskopik yöntemleri tanımlamak için kullanılır. Spektral ölçüm cihazları; spektrometre, spektrofotometre, spektrograf veya spektral analizörler olarak adlandırılır.
Işığın moleküller tarafından soğurulması moleküldeki atomların türüne, düzenlenmesine, moleküllerin şekline, büyüklüğüne vb. özelliklerine bağlı olduğundan spektroskopik yöntemler maddelerin yapılarının ve stereokimyasal özelliklerinin bulunması, tanınması ve saflık kontrolü gibi çok geniş bir alanda uygulanmaktadır.
Spektroskopik yöntemler; inorganik ve organik bileşiklerin kalitatif, kantitatif analizlerinde, asit-baz denge sabitlerinin ve molekül yapılarının aydınlatılmasında sıklıkla kullanılır. Tüm dalga boylarında çalışabilecek ve hangi dalga boylarının absorplandığını tespit edebilecek tek bir cihaz yapmak mümkün olmadığından, belirli dalga boyu aralıklarında çalışan ayrı ayrı cihazlar geliştirilmiştir. Bu cihazların geçerli oldukları alan spektroskopilerine de Ultraviyole-Görünür Bölge (UV-Visible), Infrared (IR titreşim) ve Nükleer Manyetik Rezonans (NMR) spektroskopileri adı verilir. Birçok laboratuvarda yaygın olarak; ultraviyole, görünür, kızılötesi ve radyo (nükleer manyetik rezonans) frekans aralıklarındaki ışıma emilimine veya emisyonuna dayalı spektroskopik yöntemler kullanılır.
Elektromanyetik ışınım, elektromanyetik spektrumun kozmik ve gama ışımasından (dalga boyu 10-14 ila 10-12 m), sesaltı ışımaya (1010 m) kadar geniş bir dalga boyu ve frekans yelpazesini kapsayan çok farklı sayıda form alan bir enerji türüdür. Analitik amaçlar için önemli spektral bölgelerin dalga boyu ve dalga sayısı aralıklarını gösteren diyagram Şekil’de verilmiştir.
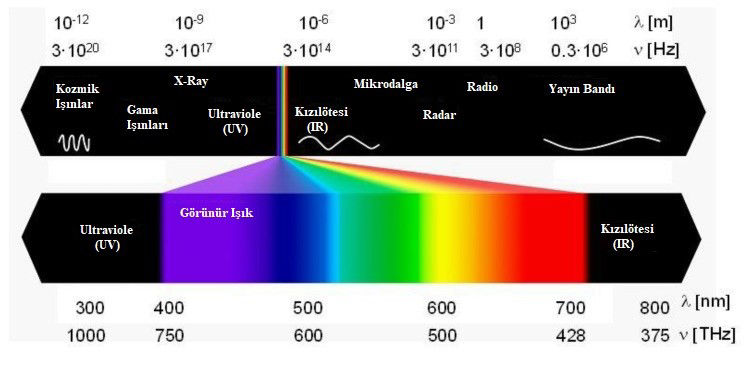
Spektroskopi terimi, bir spektrum oluşturmak için ışık veya görünür ışımanın bileşen dalga boylarına dönüştürüldüğü süreçleri belirtmektedir. Bununla birlikte günümüzde, iyonlar (kütle spektrometresi), çekirdeğin dönüşü (nükleer manyetik rezonans spektroskopisi), ses dalgaları (akustik spektroskopi) vb. gibi diğer ışıma türleri için de kullanılmaktadır. Spektroskopik teknikler analitik kimyada çok önemli bir alana sahiptir ve uygulamalar çok sayıdadır. Analitik kimyada kullanılan bazı yaygın spektroskopik teknikler; UV-Vis, floresan, IR, NIR, Raman ve Atomik Absorpsiyon Spektroskopilesidir.
Işığın Absorplanması;
Çeşitli dalga boylarında ışık içeren bir demet, saydam ve şeffaf bir ortamdan geçirilirse, içinden bazı dalga boylarının kaybolduğu görülür. Buna ışığın absorplanması denir. Absorpsiyonla ışık enerjisi, maddenin iyon, atom veya moleküllerine aktarılır. Böylece ışık enerjisini absorplamış olan iyon, atom veya moleküller uyarılmış hale geçerler. Uyarılmış bir atom veya molekül 10-8 sn. kadar yaşayabilir. Sonra absorpladığı ışık enerjisini geri vererek tekrar eski haline veya temel haline döner. Madde tarafından absorplanan ışık enerjisinin geri verilmesi, genellikle ısı şeklinde olur ve madde az çok ısınır. Bazı maddelerde ise absorplanan ışık enerjisi daha uzun dalga boylu ışıklar halinde yayılır. Buna fotolüminesans olayı denir. Bu olayın çok kısa süreli olanına floresan, daha uzun süreli olanına fosforesan adı verilir.
Bir maddenin temel haliyle uyarılmış halleri arasındaki enerji farkları, başka bir maddeninkinden farklı olduğundan, her maddenin kendine özgü bir absorpsiyon spektrumu vardır. Absorpsiyon spektrumları genel olarak iki şekilde incelenir:
1- Atomik Absorpsiyon Spektrumları
2- Moleküler Absorpsiyon Spektrumları
Aomik Absorpsiyon Spektrumları;
Polikromatik UV veya Görünür Bölge ışıkı civa veya sodyum gazı gibi tek atomlu bir ortamdan geçirilirse bazı ışıklar kaybolur. Sodyum buharından ışık geçirildiğinde sarı ışık kaybolur. Sarı ışığın sodyum atomları tarafından adsorplanması, sodyum atomlarında 3s enerji seviyesinde bulunan bir elektronun sarı ışıkı absorplayarak 3p enerji seviyesine çıkmasıyla açıklanabilir. Atomlarda, en dış tabaka elektronları ultraviyole ve görünür bölge ışıklarla uyarıldıkları halde, iç tabaka elektronları uyarılamaz. İç tabaka elektronlarını uyarabilmek için X-ışınları kullanılır. X-ışınları görünür bölge ışınlarından daha fazla enerjilidirler.
Atomların en dış tabaka elektronlarının uyarılması üzerine kurulmuş olan spektroskopi dalına atomik absorpsiyon, en iç tabaka elektronlarının uyarılması üzerine kurulmuş olan spektroskopi dalına da X-ışınları spektroskopisi denir.
Moleküler Absorpsiyon Spektroskopisi;
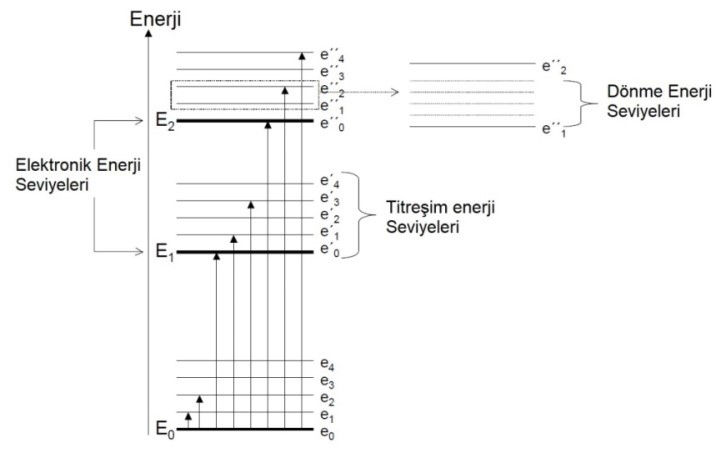
Elektromanyetik enerjinin numunenin atomlarına veya moleküllerine aktarıldığı işleme absorpsiyon denir. Elektromanyetik enerjinin absorpsiyonunu takiben, atomlar ve moleküller, ayrı seviyelerde bulunan bir veya daha fazla yüksek enerji seviyesine uyarılır. Işımanın absorpsiyonu gerçekleşmesi için uyarılan bir fotonun enerjisi temel hal ile uyarılan hallerden biri arasındaki enerji farkıyla tam olarak eşleşmelidir. Bu enerji farklılıkları her bileşik için benzersizdir ve absorplanan ışığın frekanslarının bir grafiği bu nedenle bir bileşiğin karakterizasyonu sağlar. Böylece absorpsiyon spektrumu, dalga boyunun bir fonksiyonu olarak çizildiğinde çok yararlıdır. Bir molekülün absorpsiyon bantlarıyla ilişkili E enerjisi şu şekilde verilir:
ET = Eelektronik + Etitreşim + Edönme
Burada; Eelektronik molekülün elektronik enerjisini, Etitreşim titreşim enerjisini, Edönme ise dönme enerjisini tanımlar. Bir moleküldeki dönme seviyelerinin sayısı, titreşim seviyelerinin sayısından çok daha büyüktür ve titreşim seviyelerinin sayısı, elektronik seviyelerin sayısından daha fazladır. Bu gerçekler, farklı durumlar arasındaki enerji farklılıklarıyla da ilgilidir; burada.
Eelektronik > Etitreşim > Edönme
Dolayısıyla belirli bir molekül için bir dizi elektronik enerji durumu, daha da fazla sayıda titreşim seviyesi ve aynı zamanda daha fazla dönüş seviyesi mevcut.