Spektroskopistler için, Lambert-Beer(Bouguer) yasası hiç kuşkusuz spektroskopi'nin en önemli esaslarından biri olan absorbans ile ayrılmaz biçimde ilişkili olduğu için esas teşkil eden bir ilkedir. Lambert-Beer(Bouguer) yasası monokromatik ışığın madde tarafından absorbansını ölçer.
Atom veya molekül uyarıldıktan 10-8 sn. gibi kısa bir süre sonra absorplanan ışık, enerjisini kaybederek tekrar temel enerji seviyesine döner. Madde absorpladığı ışık enerjisini genellikle ısı şeklinde geri verir ve madde çok az ısınır. Bazı maddeler ise absorplanan ışık enerjisini daha uzun dalga boylu ışınlar halinde yayar. Buna fotolüminesans olayı denir. Bu olayın çok kısa süreli olanına floresan, daha uzun süreli olanına fosforesan adı verilir. Bir maddenin temel haliyle uyarılmış halleri arasındaki enerji farkları, başka bir maddeninkinden farklı olduğundan, her maddenin kendine özgü bir absorpsiyon spektrumu vardır. Paralel ışık demeti bir bileşiğin solüsyonundan geçtiğinde absorbsiyon oluşur. Işığın, solüsyondan geçmeden önceki ışıma gücü P0 ve solüsyondan geçtikten sonraki ışıma gücü (P), çözeltinin kalınlığı (b;cm) ve konsantrasyon (c;g*L-1) 'dir.
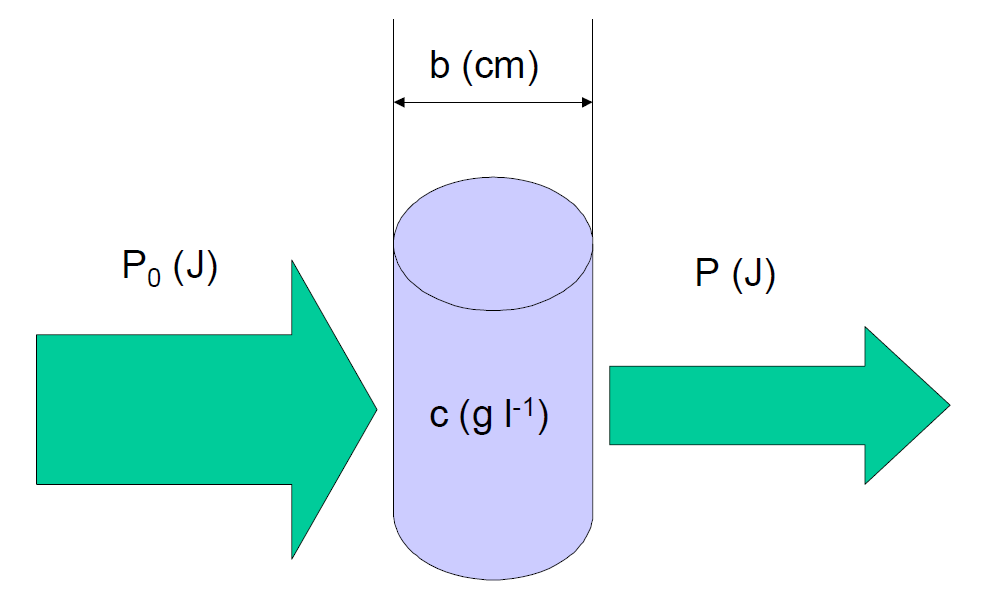
Genel kullanımda "absorpsiyon spektroskopisi" terimi kullanılsada genellikle ölçülen geçirgenlik (T)'dir. Işık demetinin ortamdan geçme oranına geçirgenlik (T) denir. Fizikokimya ve spektroskopi ders kitaplarına göre, bir materyalin veya bir çözeltinin geçirgenlik T değeri iyi bilinen bir formül ile absorbsiyona dönüştürülür. Çözeltiden iletilen ışımanın franksiyonuna geçirgenlik (T) denir.
T=P/P0
şeklinde ifade edilir. Geçirgenlik genellikle yüzde cinsinden verilir.
%T=P/ P0 *100
Geçirgenlik ifadesinin eksi logaritması alınarak Absorbans (A) elde edilir.
-logT = -log P/P0 = A
Burada, P0, ışığın solüsyondan geçmeden önceki ışıma gücü veya ışınımıdır ve P, ışığın solüsyon ile etkileşimde bulunduktan sonra çıkan ışık şiddetidir. Bir çözeltinin absorbansı, çözelti boyunca yol uzunluğu (b) ve absorplayıcı türlerin konsantrasyonu (c) ile doğru orantılıdır. Moleküllerin seçilen dalga boyundaki ışımayı absorplaması sonucu ortaya çıkan azalma Lambert-Beer(Bouguer) veya Beer’s eşitliği ile verilir. Eşitlikte; geçirgenlik doğrudan; molar absorpsiyon katsayısı (ε), absorbansı olmayan çözücü içerisinde çözünen absorplayıcı madde konsantrasyonu (c) ve çözeltinin kalınlığı (b)’ye bağlıdır.
A = log P0 / P = ε.b.c
Absorbans birimi, Absorbans Unit (AU) ile ifade edilir. Bu yasanın bir sınırlaması, sadece yaklaşık <1.5 AU'luk absorbansa sahip solüsyonlar için doğrusal olmasıdır. Dolayısıyla, çok yüksek konsantrasyonda absorpsiyon ve konsantrasyon arasındaki doğrusallık ilişkisi bozulur ve sapmalar yaşanır.